在容积相同的甲、乙两个密闭容器中,均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g) 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
| A.反应过程中的某时刻,甲容器中的反应速率比乙中的大 |
| B.达到平衡时,甲容器反应所需时间比乙容器少 |
| C.乙容器中SO2的转化率大于25% |
| D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2 |
1
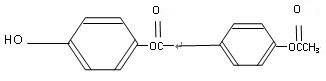 与足量的
溶液充分反应,消耗的
的物质的量为
与足量的
溶液充分反应,消耗的
的物质的量为

| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
关于有机化合物的叙述中正确的是
| A.苯能使酸性KMnO4溶液褪色 | B.汽油、柴油和植物油都是碳氢化合物 |
| C.乙醇是一种可再生能源 | D.甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
背景材料:①“神舟七号” 的防护层由聚四氟乙烯和玻璃纤维布组合而成;②光化学烟雾是导致珠三角地区空气质量下降的重要原因;③汞是有毒的金属;④据环境质量监测所抽查显示,新装修住房甲醛含量七成超标。⑤在广东、香港海域,渤海湾均出现过大面积的赤潮。据此判断,下列说法正确的是
(1)“神舟七号” 的防护层是复合材料,四氟乙烯属于不饱和烃。
(2)光化学污染主要是由氮氧化物和碳氢化物引起的。
(3) 打破水银温度计应撒上硫磺并扫干净
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象
| A.(1)(2)(3) | B.(1)(2)(5) | C.(2)(3)(5) | D.(2)(4)(5) |
金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关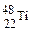 和
和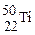 的说法中正确的是
的说法中正确的是
A.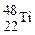 和 和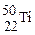 的质量数相同,互称为同位素 的质量数相同,互称为同位素 |
B.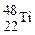 和 和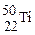 的质子数相同,互称同位素 的质子数相同,互称同位素 |
C.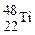 和 和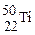 的质子数相同,是同一种核素 的质子数相同,是同一种核素 |
D.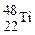 与 与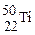 核外电子数相同,中子数不同,不能互称为同位素 核外电子数相同,中子数不同,不能互称为同位素 |
在容积为VK的密闭容器中发生2NO22NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。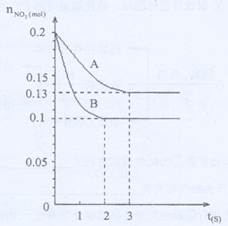
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是()
A.有、无催化剂B.温度不同C.压强不同D.V值不同
(2)写出该反应的化学平衡常数K的表达式,并比较K800℃K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2=。
(4)不能说明该反应已达到平衡状态的是()
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变