已知NaHSO4在水中的电离方程式为:NaHSO4==Na++H++SO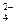 某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。
某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。
下列叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为10的NaOH溶液可使该溶液恰好呈中性 |
设NA为阿伏加德罗常数,下列有关叙述正确的是()
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA 7.8 g Na2O2含有的阴离子数目为0.2 NA
7.8 g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
著名化学家徐光宪,因为在稀土萃取领域取得了卓越成就而获得“国家最高科学技术奖”,被誉为“稀土界的袁隆平”。稀土元素是指镧系的15种元素,加上钪和钇共17种元素。下列说法正确的是()
A.稀土元素全部是金属元素
B.要萃取出碘酒中的碘可以使用氢氧化钠溶液做萃取剂 镧系元素均属于第七周期、第ⅢB族的元素
镧系元素均属于第七周期、第ⅢB族的元素
D.某些稀土元素在地壳中的含量高于铝
X、Y是原子序数相差2的两种短周期元素,下列相关说法正确的是
| A.X与Y可能位于同一周期,但不可能位于同一主族 |
| B.X与Y可能形成原子个数比为1 :1型的共价化合物,但不能形成原子个数比为1 :1型的离子化合物 |
| C.X离子与Y离子的电子层结构可以相同,也可以不同 |
| D.X与Y形成的共价化合物中,其原子个数之比可能是1 :1、1 :2,但不能是1 :3 |
下列叙述不正确的是
| A.CH4O和C2H6O都符合CnH2n+2O的通式,它们可能互为同系物 |
| B.16 g CH4与18 gNH4+所含质子数相等 |
| C.32S与33S的质子数相等,属于同一种元素的不同核素 |
| D.质量相等、体积不等的N2和C2H4的分子数一定相等 |
关于下列各装置图的叙述中,正确的是
| A.装置甲中,d为阳极、c为阴极 |
| B.装置乙可用于收集H2、NH3、CO2、Cl2、NO等气体 |
| C.装置丙中X若为四氯化碳,可用于吸收氨气或氯化氢等易溶于水的气体,并能防止倒吸 |
| D.装置丁可用于实验室制取并收集乙酸乙酯 |