已知:2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)ΔH="-226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是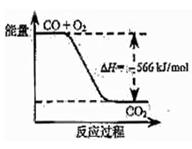
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
在平衡体系2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应),能使SO3的产量增加的措施是()
2SO3(g)(正反应为放热反应),能使SO3的产量增加的措施是()
| A.升高温度 | B.加入催化剂 | C.降低压强 | D.通入氧气 |
在含有酚酞的0.1mol/L氨水中加少量的NH4Cl晶体,则溶液颜色()
| A.变蓝色 | B.变深 | C.变浅 | D.不变 |
下列反应,硝酸既表现了酸性,又表现了氧化性的是()
| A.Fe2O3 + HNO3 | B.C + HNO3 | C.Cu + HNO3 | D.CuO + HNO3 |
在反应2A(g) + B(g) 2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是()
2C(g)(正反应放热)中,为了增大A的转化率,应采用的反应条件是()
| A.高温、高压 | B.高温、低压 | C.适当温度、高压 | D.低温、低压 |
盛放浓硝酸的试剂瓶里出现黄色是因为硝酸具有()
| A.酸性 | B.不稳定性 | C.强氧化性 | D.挥发性 |