用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即转入容量瓶,将洗涤烧杯内的液体注入容量瓶后,加蒸馏水至刻度线。
③中和滴定时,锥形瓶内有少量水。
④酸式滴定管用蒸馏水洗涤后,未用标准液润洗。
⑤读取滴定管终点读数时,仰视刻度线。
| A.①②③ | B.②④⑤ | C.③④⑤ | D.全部 |
下列离子方程式中正确的是
| A.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- → NH3↑+2H2O |
| B.向FeBr2溶液中通入Cl2,当n(FeBr2)=n(Cl2)时:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl- |
| C.向FeI2溶液中通入Cl2,当n(FeI2):n(Cl2)=1:1时: 2I-+Cl2→I2+2Cl- |
| D.向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时: OH-+CO2→HCO3- |
下表是一些共价键的键能(kJ/mol)数据, 以下表达中肯定正确的是
| 共价键 |
键能 |
共价键 |
键能 |
| H-H |
436 |
H-F |
565 |
| C-F |
427 |
H-S |
339 |
| C-Cl |
330 |
H-Se |
314 |
A.H2(g)→2H (g)-436kJ
B.键长越短, 共价键越牢固
C.相同条件下CH3F比CH3Cl更易发生水解反应
D.相同压强下,H2S的沸点比 H2Se的沸点高
如图所示,a、b是两根石墨棒。下列叙述正确的是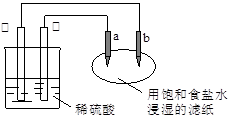
| A.a是正极,发生还原反应 |
| B.b是阳极,发生氧化反应 |
| C.稀硫酸中硫酸根离子的物质的量不变 |
| D.往滤纸上滴加酚酞试液,a极附近颜色变红 |
下列实验操作正确的是
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验醛基
③实验室制硝基苯要在水浴的热水中插入温度计
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
| A.①④ | B.②④⑤ | C.①③ | D.③④⑥⑦ |
下列物质的转化在给定条件下能实现的是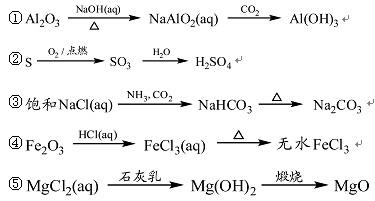
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |