在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
CO2(g)+H2(g) ΔH<0,下列对图像的分析中不正确的是( )
| A.图Ⅰ研究的是t0时升高温度对反应速率的影响 |
| B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
右图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是()
| 选项 |
X |
收集气体 |
 Y Y |
| A |
碱石灰 |
氯化氢 |
水 |
| B |
碱石灰 |
氨气 |
水 |
| C |
氯化钙 |
二氧化硫 |
氢氧化钠 |
| D |
氯化钙 |
一氧化氮 |
氢氧化钠 |
设NA代表阿伏加德罗常数,下列叙述正确的是()
| A.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C.常温常压下42g 乙烯和丁烯混合气体中,碳氢键的数目为6NA |
| D.6.4g SO2与3.2g氧气反应生成SO3,转移电子数为0.2NA |
t℃时,水的离子积为KW。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是 ()
| A.pH=7 | B.c(OH-)=c(H+)=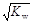 |
| C.c(A-) > c(B+) | D.c(H+)-c(OH-)=c(A-)-c(B+) |
下列各溶液中,一定能大量共存的是()
| A.Fe2+、Na+、SO42-、H2O2 | B.SO32-、MnO4-、H+、K+ |
| C.Pb2+、K+、SO42-、Cl- | D.Na+、SO32- 、K+、SO42- |
随着从们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是()
| A.无水硫酸铜、蔗糖 | B.生石灰、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |