A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质。
(1)D的原子结构示意图为 ;
;
(2)元素E在元素周期表中位于第 族;
族;
(3)C、D、E离子半径的大小关系为 (用离子符号表示);
(4)元素B的单质与元素C的单质可发生化学反应生成化合物甲,则甲的化学式为
,实验证明甲能够与水发生化学反应,试写出甲与水反应的离子方程式
;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则x y(填写“>”、“<”或“=”=;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产 物不污染环境,其化学方程式为 (不需要配平)。
物不污染环境,其化学方程式为 (不需要配平)。
英国国家海洋学中心于2009年8月14日发布新闻公报说,中心的研究人员及其同行利用声呐等手段探测到北极海洋中存在大量甲烷气泡,证实了全球变暖会使海底释放大量甲烷的说法。研究人员认为,这些甲烷可能会反过来加剧全球变暖。


(1)右图是1molCH4和O2完全反应生成CO2气体与水蒸气过程中能量变化示意图,又已知 H2O(l)=H2O(g) △H=44.0kJ·mol-1,请写出1molCH4和O2完全反应生成CO2气体与液态水的热化学方程式。
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,氢气虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。电池的构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
①请写出甲烷燃料电池中a极的电极反应式为。
②此时电池内的总反应方程式为。
(3)某课外活动小组利用右图所示装置探究甲烷于氯气的反应。根据题意,回答下列问题:
①CH4与Cl2发生反应的条件是;若用日光直射,可能会引起。
②实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,,等。
③用饱和食盐水而不用谁的原因是。
④实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2→2COCl2+2HCl,上述反应(填选项符号,下同)
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液 C.稀盐酸
D.水 E.湿润的蓝色石蕊试纸F.湿润的无色酚酞试纸
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸。据此回答下列问题: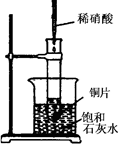
(1)实验中观察到的现象是;
(2)产生上述现象的原因是;
(3)写出有关反应的化学方程式;
(4)由实验推知,反应后产物的总能量(填“大于”、“小于”、“等于”)硝酸和铜片的总能量。
(5)该装置有明显的不足,原因是,改进的方法是。
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃。李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答: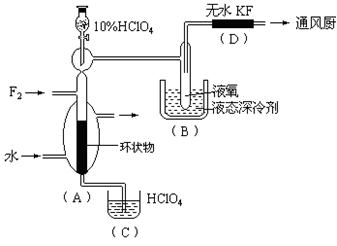
(1)实验中生成X的化学方程式是;
(2)现有10%和30%的HClO4,李明最好选用,理由是;
(3)B中冷却剂选用液氧的理由是;
(4)A中填充环状物的作用是。
溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯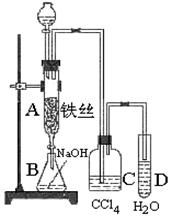 。先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中。
。先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中。
(1)写出A中反应的化学方程式;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,C中盛放CCl4的作用是;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入溶液,现象是,则能证明;或者向试管D中加入溶液,现象是。
原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D的离子结构示意图是,A和B形成的化合物中含有非极性共价键的是,该物质的电子式是。
(2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式。