有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,不正确的是
A.A、B的相对分子质量之差为42
B.B分子自身可发生缩聚反应生成高分子化合物
C.A的分子式是C7H6O3
D.B能与NaOH溶液、FeCl3溶液、溴水等物质反应
下列各组离子,一定能大量共存的是()
| A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+ |
| B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32- |
| C.加入铝粉能产生氢气的溶液:NH4+、Fe2+、SO42-、Cl- |
| D.由水电离出的c(H+)=1×10-12 mol?L-1溶液中:K+、Cl-、NO3-、Na+ |
少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2的产量,可以使用如下方法中的()
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.⑤⑥⑧ |
在一定温度下,反应H2(g)+X2(g) 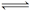 HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
| A.5% | B.17% | C.25% | D.33% |
在新制的氯水中存在下列平衡:Cl2+H2O H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
| A.pH增大,HClO浓度减小 |
| B.pH减小,HClO浓度增大 |
| C.pH增大,HClO浓度增大 |
| D.pH减小,HClO浓度减小 |
下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是()
| A.CH3COOH | B.Al2(SO4)3 | C.NaHSO4 | D.Na2CO3 |