用NA代替阿伏伽德罗常数,下列叙述中正确的是
| A.常温常压下,1 mol羟基和1molOH-所含的电子数均为10 NA |
| B.Cu、Zn和稀硫酸组成的原电池工作时,Cu极生成0.2 g H2,则电路中通过0.2 mol电子 |
| C.标准状况下,22.4 L SO3所含的分子数为NA,任意条件下,16g O3所含的原子数为NA |
| D.l mol Na2O2,与足量水反应,转移电子的物质的量为2 mol |
一定温度下,对可逆反应A(g)+2B(g)  3C(g)的叙述中,能说明反应已达到平衡的是( )
3C(g)的叙述中,能说明反应已达到平衡的是( )
| A.C生成的速率与C分解的速率相等 |
| B.单位时间内消耗a mol A,同时生成3a mol C |
| C.容器内的压强不再变化 |
| D.混合气体的物质的量不再变化 |
已知4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.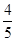 v(NH3)=v(O2) v(NH3)=v(O2) |
B.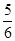 v(O2)=v(H2O) v(O2)=v(H2O) |
C.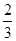 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.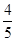 v(O2)=v(NO) v(O2)=v(NO) |
在密闭容器中A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为 ( )
A.2A+3B===2C B.A+3B===2C C.3A+B===2C D.A+B===C
由下图分析,有关叙述正确的是( )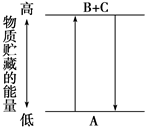
| A.A―→B+C和B+C―→A两个反应吸收或放出的能量不等 |
| B.A―→B+C是放热反应 |
| C.A具有的能量高于B和C具有的能量总和 |
| D.A―→B+C是吸热反应,则B+C―→A必然是放热反应 |
已知下列热化学方程式:
Zn(s)+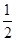 O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+
O2(g)==="ZnO(s)" ΔH1=-351.1 kJ/mol Hg(l)+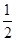 O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
O2(g)==="HgO(s)" ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l)ΔH3,其中ΔH3的值是()
| A.-441.8 kJ/mol | B.-254.6 kJ/mol | C.-438.9 kJ/mol | D.-260.4 kJ/mol |