将V L(标准状况)氯化氢气体溶于0.2 L水中,所得盐酸溶液的密度是a g/cm3,则所得盐酸溶液的物质的量浓度(mol/L)为
| A.aV/(4480+36.5V) | B.1000aV/(36.5V+4480) |
| C.36.5V/22.4a(V+0.2) | D.3650aV/(36.5V+4480) |
下列操作会导致实验结果偏高的是()
| A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 |
| B.中和滴定测定盐酸浓度,量取20.00 mL盐酸时未用待测液润洗酸式滴定管 |
| C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量 |
| D.配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度 |
取8.34 g FeSO4·7H2O样品加热,其受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,则下列叙述中不正确的是()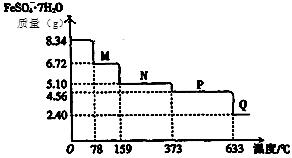
| A.温度为78℃时固体物质M的化学式为FeSO4•4H2O |
| B.温度为l59℃时固体物质N的化学式为FeSO4•H2O |
C.在隔绝空气条件下,N得到P的化学方程式为:FeSO4  FeO+SO3↑ FeO+SO3↑ |
| D.固体P隔绝空气加热至650℃,得到一种固体物质Q,同时有三种无色气体生成,Q的化学式为Fe2O3 |
下列有关判断、叙述正确的是()
| A.质量分数为W的氨水其浓度为C1 mol/L,则质量分数为2W的氨水,其浓度大于2C1 mol/L |
| B.3.2克的甲烷与标准状况下8.96 L的水所含有的氢原子数相同 |
| C.铅蓄电池中放电时转移2NA个电子,则电池内消耗4 mol H2SO4 |
| D.等质量的SO2与SO3所含有的氧原子数之比为5:6 |
用下列实验装置进行相应的实验,能达到实验目的的是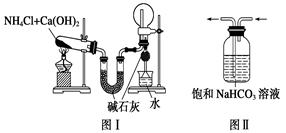
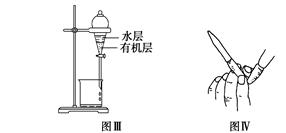
| A.图Ⅰ用于实验室制氨气并收集干燥的氨气 | B.图Ⅱ用于除去CO2中含有的少量HCl |
| C.图Ⅲ用于提取I2的CCl4溶液中的I2 | D.图Ⅳ用于检查碱式滴定管是否漏液 |
将KClO3、I2各0.02 mol加入12 克36.5%的盐酸中,I2恰好完全溶解,没有气体产生(不考虑盐酸的挥发)。将反应后的溶液用冰水冷却,析出橙红色晶体A(A在常温下就有升华现象),过滤,将滤液蒸干,收集到KCl固体、8.7g液态水和极少量的A蒸气。则A的化学式可能是()
| A.I2Cl6 | B.ICl5 | C.HClO | D.KIO3 |