在一定温度下的密闭容器中, 能表示 A(s)+2B(g) C(g)+D(g) 已达到平衡状态的是( )
C(g)+D(g) 已达到平衡状态的是( )
①混合气体的压强,②混合气体的密度,③B的物质的量浓度,④气体的总物质的量,⑤混合气体的平均相对分子质量,⑥v(C)与v(D)的比值
A. ①②③ B. ②③④⑥ C.②③⑤ D.①③④⑤
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)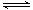 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O
△H =-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀盐酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H2<△H3 |
| C.△H1<△H2=△H3 | D.△H1=△H2<△H3 |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
在25℃、101 kPa下,1 g甲醇( CH3OH)燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是()
A.CH3OH(l)+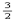 O2(g)===CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol O2(g)===CO2(g)+2H2O(l);ΔH="+725.8" kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-1452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH="+1452" kJ/mol |