在AlCl3和FeCl3混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是
| A.Fe(OH)3、Al(OH)3 | B.Al(OH)3、I2 |
| C.Fe2S3、I2 | D.FeS、S、Al(OH)3 |
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是

A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件一定是增大了反应物的浓度 |
| C.图二t1时改变的条件可能是升高了温度或增大了压强 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )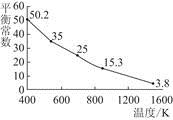
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7 ③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
| A.①②③④ | B.①③④ | C.①③ | D.②④ |
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
| A.AY溶液的pH小于7 |
| B.AY溶液的pH小于BY溶液的pH |
| C.稀释相同倍数,BX溶液的pH变化小于BY溶液 |
| D.电离平衡常数K(BOH)小于K(HY) |