低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:
4NH3(g) + 6NO(g)  5N2(g) + 6H2O(g) ΔH<0
5N2(g) + 6H2O(g) ΔH<0
在恒容密闭容器中,下列有关说法正确的是:
| A.平衡时,其他条件不变,降低温度可使该反应的平衡常数减小 |
| B.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
| C.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| D.单位时间内消耗NH3和H2O的物质的量比为2∶3时,反应达到平衡 |
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
| A.铜片、铁片、FeCl3溶液组成的原电池 |
| B.石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 |
| D.铜片、铁片、Fe(NO3)3溶液组成的原电池 |
短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。下列判断错误的是
| A.E是一种非金属元素 | B.在ECln中E与Cl之间形成共价键 |
| C.E的一种常见氧化物为EO | D.E位于元素周期表的ⅥA族 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应
SO2(g)+NO2 (g)  SO3(g)+NO(g)
SO3(g)+NO(g)
达到平衡,正反应速率随时间变化的示意图如下图所示。由图可得出的不正确结论是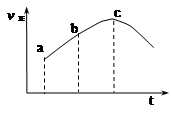
| A.反应物的总能量高于生成物的总能量 |
| B.反应物浓度:a点大于b点 |
| C.反应在c点达到平衡状态 |
| D.SO2的转化率:a点小于b点 |
CO(g)+H2O(g)  H2(g)+CO2(g)△H<0,在其他条件不变的情况下,下列说明正确的是
H2(g)+CO2(g)△H<0,在其他条件不变的情况下,下列说明正确的是
| A.加入催化剂,改变了反应的途径,反应放出的热量也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
下列微粒中: ①13Al3+,② 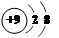 ,③
,③ 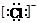 ,④F-,其核外电子数相同的是
,④F-,其核外电子数相同的是
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |