向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如右图所示。则下列说法中正确的是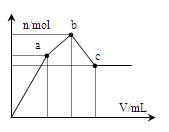
| A.a点对应的沉淀只有BaSO4 |
| B.c点溶液呈碱性 |
| C.b点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— ="=" Al(OH)3↓+2BaSO4↓ |
| D.c点加入Ba(OH)2溶液的体积为200 mL |
下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A、10 mL 0.5 mol/L CH3COONa溶液与6 mL 1  mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B、0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;把金属X分别浸入M2+和Y2+的盐溶液中,只有金属Y析出。则这四种金属的活动性由强到弱的顺序为
| A.X>Z>Y>M | B.M>X>Z>Y | C.M>X>Y>Z | D.X>Z>M>Y |
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:4OH--4e-=2H2O+O2↑ |
| D.1 mol二价镍全部转化为三价镍时,外电路中通过了1 mol电子。 |
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.69g锌粒,则下图所示比较符合 客观事实的是( )
客观事实的是( )
甲烷与氯气以物质的量之比1∶3混合,在光照下得到的产物:①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4,正确的是()
| A.只有① | B.只有② |
| C.①②③的混合物 | D.①②③④的混合物 |