某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系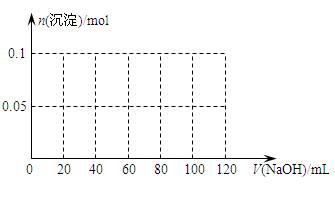
PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线: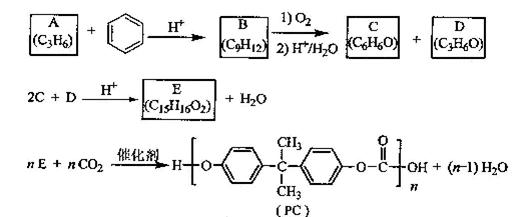
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是;
(2)B的结构简式为;
(3)C与D反应生成E的化学方程式为;
(4)D有多种同分异构体,其中能发生银镜反应的是(写出结构简式);
(5)B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是(写出结构简式)。
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为。
(2)25℃时,HF电离常数的数值Ka ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为(填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为,两溶液中c (F-)c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g)  pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x=、y=、p=、q=;
(2)反应2min内,vA =;
(3)反应平衡时,D为 2amol,则B的转化率为;
(4)已知该反应在不同温度下的平衡常数如下:
| 温度℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
该反应的平衡常数表达式K=_____________,ΔH ________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”) ;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是
。
请将氧化还原反应:2Fe3++2I- 2Fe2++I2设计成带盐桥原电池。
2Fe2++I2设计成带盐桥原电池。
试剂:FeCl3溶液,KI溶液;其它用品任选。
请回答下列问题。
(1)请画出设计的原电池装置图,并标出电极材料,电极名称及电解质溶液。
(2)发生还原反应的电极为电池的极,其电极反应式为。
(3)反应达到平衡时,外电路导线中(填“有”或“无”)电流通过。
(4)平衡后向FeCl3溶液中加入少量FeCl2固体,当固体全部溶解后,则此溶液中电极变为(填“正”或“负”)极。
(5)请设计简单实验,证明溶液中同时存在Fe3+、Fe2+。
向10 0mLBa(OH)2溶液中加
0mLBa(OH)2溶液中加 入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
入过量的NaHCO3溶液生成BaCO3沉淀,过滤,将沉淀置于过量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)Ba(OH)2与过量的NaHCO3溶液反应的化学方程式。
(2)生成BaCO3沉淀的质量__________g。
(3)100mL Ba(OH)2溶液中溶质Ba(OH)2的物质的量浓度__________mol/L。
(4)最初加入的NaHCO3溶液中含NaHCO3的物质的量__________mol。