下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。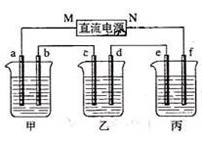
⑴、接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①、电源的N端为 ▲ 极;
②、电极b上发生的电极反应为 ▲ ;
③、列式计算电极b上生成的气体在标准状况下的体积为 ▲ ;
④、电极c的质量变化是 ▲ g;
⑤、电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ▲ ;乙溶液 ▲ ;丙溶液 ▲ 。
⑵、如果电解过程中铜全部析出,此时电解 ▲ (填“能”或“否”)继续进行,理由是 ▲ 。
下列结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表代价键(示例F2):  。
。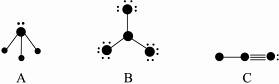
根据各图表示的结构特点,写出各分子的化学式:
A ,B ,C 。
下列五种物质中①Ar②CO2③SiO2④NaOH⑤K2S,只存在共价键的是___________,只存在离子键的是___________,既存在离子键又存在共价键的是___________,不存在化学键的是___________。(填序号)
由A、B元素组成的含4个原子核和42个电子的-2价阳离子中,1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为和。
(2)写出该阴离子的离子符号。
(3)该阴离子与钠离子形成的化合物中含有键。
A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可发生如下变化,且D与酸性氧化物、碱性氧化物均能反应。
A+B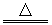 C+D B+E====2D
C+D B+E====2D
(1)写出A的电子式______________。
(2)写出B的化学式______________。
(3)写出D的电子式______________。
已知离子键的键能与阴阳离子的电荷乘积成正比,与离子间的距离平方(可视为阴阳离子半径之和)成反比,若阳离子是Na+、K+、Rb+、Cs+,则其氯化物的熔点高低顺序是:____________。