下列热化学方程式或离子方程式中,正确的是:( )
| A.甲烷的标准燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1 |
|
| B.500℃、30MPa下,将0.5mol N2和1.5molH2经过催化剂生成NH3(g)放热19.3kJ,其 500℃,30MPa |
C.氯化镁溶液与氨水反应:Mg2++2OH- = Mg(OH)2↓ |
| D.氧化铝溶于NaOH溶液:Al2O3+2OH- = 2AlO2-+H2O |
下列溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| B.室温下,向0.01mol/LNH4HSO4溶液中滴加等体积0.01mol/LNaOH溶液: c(Na+)=c(SO42-)>c(NH4+).>c(H+)>c(OH-) |
| C.Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| D.25℃时,浓度均为0.1mol/L的CH3COOH和CH3COONa等体积混合: |
c(CH3COOH)+c(CH3COO-)=0.2mol/L
银锌(Ag—Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应式为Ag2O + Zn + H2O  2Ag + Zn(OH)2,下列说法正确的是
2Ag + Zn(OH)2,下列说法正确的是
| A.放电时Zn参与反应的电极为正极 |
| B.放电时负极附近的pH逐渐增大 |
| C.充电时阴极的电极反应为:Zn(OH)2 -2e-= Zn + 2OH- |
| D.充电时每生成1 mol Ag2O转移2 mol电子 |
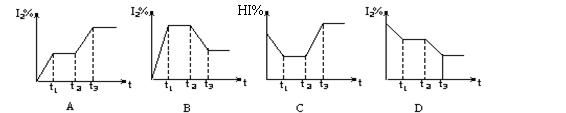
在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
| A.CuSO4粉末 | B.K2 SO4固体 | C.(NH4)2 SO4粉末 | D.CH3COONa固体 |
下列叙述不正确的是
| A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| C.原电池中电流由正极流向负极,阳离子向正极移动 |
| D.用惰性电极电解AgNO3溶液一段时间后,加入一定质量Ag粉,溶液能恢复原状 |