图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题: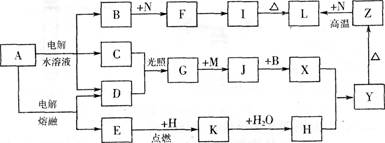
(1)Z→L反应的名称是 。
(2)K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B的混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出该反应的离子方程式 。
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2, X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子.
(1)该融雪剂的化学式是;X与氢元素形成的化合物的电子式是.
(2)元素D.E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是;D与E能形成一种非极性分子,该分子的结构式为;D所在族元素的氢化物中,沸点最低的是
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为.
(1)配平氧化还原反应方程式:C2O42-+MnO4-+H+=CO2+Mn2++H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由变为。该溶液中还原剂的物质的量为mol。
如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A.B两极发生反应的电极反应式A:B:
(2)请分析A.B两极质量变化情况为A:B:
下图所示为实验制取纯净干燥的Cl2,并进行检验Cl2性质的实验装置。其中E瓶中放有干燥红色布条,F中为铜网,F右端出气管口附有脱脂棉。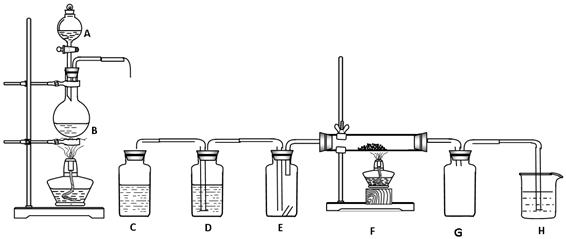
(1)洗气瓶C、D中分别盛有的试剂是 、 。
(2)E中现象是 ,
(3)F中反应的化学方程式为 。
(4)B中反应的离子方程式为 。
(5)整套装置中有两处酒精灯加热,实验时应先点燃 处的酒精灯。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1) A、B、C、D中所有原子都在同一平面上的是________________________。
(2)写出下列反应的反应类型:①____________,④______________。
(3)写出下列反应的化学方程式:
①______________________________________________________;
②_______________________________________________________;
④________________________________________________________。