向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
| 微粒 |
H+ |
OH- |
CH3COO- |
CH3COOH |
| 物质的量浓度 |
增大 |
减小 |
减小 |
增大 |
则X物质可能为 ( )
| A.氯化氢 | B.氢氧化钠 |
| C.蒸馏水 | D.醋酸 |
下面均是正丁烷与氧气反应的热化学方程式(25 ℃,101 kPa):
①C4H10(g)+ O2(g) = 4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
O2(g) = 4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
②C4H10(g)+ O2(g) = 4CO2(g)+5H2O(g)ΔH=-2 658 kJ·mol-1
O2(g) = 4CO2(g)+5H2O(g)ΔH=-2 658 kJ·mol-1
③C4H10(g)+ O2(g) = 4CO(g)+5H2O(l)ΔH=-1 746 kJ·mol-1
O2(g) = 4CO(g)+5H2O(l)ΔH=-1 746 kJ·mol-1
④C4H10(g)+ O2(g) = 4CO(g)+5H2O(g)ΔH=-1 526 kJ·mo-1
O2(g) = 4CO(g)+5H2O(g)ΔH=-1 526 kJ·mo-1
由此判断,正丁烷的燃烧热ΔH为
| A.-2 878 kJ·mol-1 | B.-2 658 kJ·mol-1 |
| C.-1746 kJ·mol-1 | D.-1526 kJ·mol-1 |
下列说法正确的是
A.CH4(g) + 3/2O2(g) ==CO(g) +2H2O(l) ΔH==-a kJ·mol—1,这里ΔH代表燃烧热
B.在250C、101kPa,1mol硫和2mol硫的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量的相对大小决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
C(s)+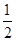 O2(g)=CO(g) △H=―393.5kJ/mol
O2(g)=CO(g) △H=―393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=―890.3kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800kJ/mol
下列设备工作时,将化学能转化为热能的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 硅太阳能电池 |
锂离子电池 |
太阳能集热器 |
燃气灶 |