下列操作会导致实验结果偏高的是 ( )
| A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值 |
| B.定容后反复摇匀发现液面低于刻度,没有再加水,所得溶液的浓度 |
| C.配制一定物质的量浓度的溶液时,用量筒量取浓溶液的体积时仰视读数,所得溶液的浓度 |
| D.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量 |
下列实验所对应的离子方程式正确的是()
| A.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+ HCO3- |
| B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+ |
| C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
| D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-=Fe4[Fe(CN)6]2↓ |
化学与生活密切相关,下列说法不正确的是 ()
| A.人体内不含消化纤维素的消化酶,因此食物纤维对人体无用 |
| B.碳酸氢钠可用于治疗胃酸过多和焙制糕点 |
| C.油脂从化学成分上讲属于酯类化合物,是人类的主要营养物质之一 |
| D.维生素有20多种,它们多数在人体内不能合成,需要从食物中摄取 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:c(OH-)+c(A2-) = c(H+)+c(H2A)
实验室中配制碘水,往往是将I2溶于KI溶液中,即可得到浓度较大的碘水,原因是发生了反应:I2(aq)+I-(aq) I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
I3-(aq)。在反应的平衡体系中,c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态)。
下列说法正确的是
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率大小为v(A)>v(C)
C.D状态时,v正>v逆
D.欲配制浓度较大的氯水,可将氯气通入氯化钾溶液中
下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
微粒组 |
所加试剂 |
离子方程式 |
| A |
NH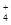 、Fe2+、SO 、Fe2+、SO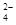 |
少量Ba(OH)2溶液 |
2NH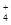 + 2NH + 2NH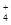 +SO +SO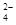 +Ba2++2OH- +Ba2++2OH-→ BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO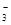 、Cl- 、Cl- |
过量NaOH溶液 |
Mg2++2HCO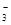 +4OH- +4OH-→ Mg(OH)2↓+2CO 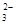 +2H2O +2H2O |
| C |
Fe2+、NO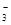 、HSO 、HSO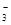 |
NaHSO4溶液 |
HSO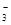 +H+→ SO2↑+H2O +H+→ SO2↑+H2O |
| D |
K+、NH3·H2O、CO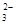 |
通入少量CO2 |
2NH3·H2O+CO2 → 2NH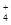 +CO +CO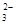 |