应用元素周期律分析下列推断,其中正确的组合是 ( )
①第三周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
②砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl
③第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
④铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
| A.①②④ | B.③④ | C.①③④ | D.① |
19世纪中叶,发现元素周期律的化学家是( )
| A.居里夫人 | B.侯德榜 | C.门捷列夫 | D.道尔顿 |
按下图的装置进行电解,A极是铜锌含金,B极为纯铜。电解质溶液中含有足量的Cu2+。 通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A极合金中Cu、Zn的原子个数比为 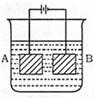
| A.4:1 | B.3:1 | C.2:1 | D.5:3 |
用惰性电极电解2L的1mol/LCuSO4溶液,在电路中通过0.05mol电子后,调换电源的正、负极,电路中又通过了1mol电子,此时溶液中H+的浓度是
| A.1.5mol/L | B.0.75mol/L | C.0.5mol/L | D.0.25mol/L |
最近,科学家冶炼出纯度高达99.999 %的铝,你估计它具有性质是()
| A.熔点比铁铝合金小 |
| B.在冷、浓HNO3中可以钝化 |
| C.在空气中放置容易生锈,进而被腐蚀 |
| D.当它与铁的粉碎粒度相同时,与4mol/L盐酸反应速率比纯铁大 |
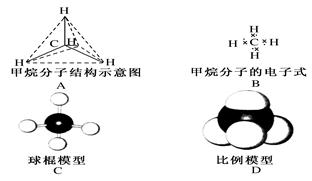
下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况