在恒温恒压的条件下,一密闭容器内发生反应:2NO2(g) 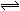 N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数( )
| A.不变 | B.增大 | C.减小 | D.无法判断 |
一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐),家庭常用的漂白水,食盐,氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应方程式为2Al+3ClO-+2OH-=3Cl-+2AlO2-+H2O。下列说法不正确的是( )
| A.该电池的优点是电极材料和电解质用完后可以更换 |
| B.该电池发生氧化反应的是金属铝 |
| C.电极的正极反应式为3ClO-+3H2O+6e-=3Cl-+6OH- |
| D.当有0.1 mol Al完全溶解时,流经电解液的电子个数为1.806×1023 |
小军利用家中的废旧材料制作了一个可使玩具扬声器发出声音的电池,装置如图所示。下列有关该电池工作时的说法错误的是( )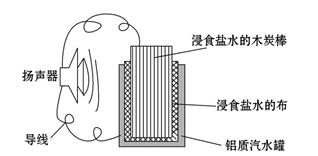
| A.铝质汽水罐将逐渐被腐蚀 |
| B.电子流向为铝质汽水罐→导线→扬声器→导线→木炭棒 |
| C.食盐水中的Na+向木炭棒移动 |
| D.木炭棒上发生的反应为2H++2e-=H2↑ |
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。下列有关说法中错误的是( )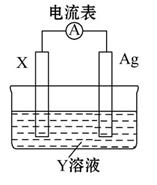
| A.电解质溶液Y是CuSO4溶液 |
| B.电极X的材料是Cu |
| C.银电极为电池的正极,其电极反应为Ag++e-=Ag |
| D.外电路中的电子是从X电极流向Ag电极 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )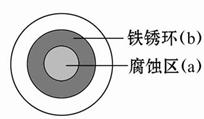
| A.液滴中的Cl-由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |