常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的硫酸盐溶液可以和强酸、强碱反应 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:3Fe2+ + 2S2O32- + O2 + aOH-=" Y+" S4O62- + 2H2O,下列说法中不正确的是
| A.a=4 |
| B.将Y均匀分散到水中形成的体系具有丁达尔效应 |
| C.S2O32-是还原剂 |
| D.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是 
| A.工业上通过电解熔融状态MgCl2制取金属镁 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第②、④步骤中,溴元素均被氧化 |
| D.制取NaHCO3的反应是利用其溶解度小于NaCl |
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)△H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g)△H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
| A.在该条件下,反应前后的压强之比为6 :5.3 |
| B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
有关下列图象的说法正确的是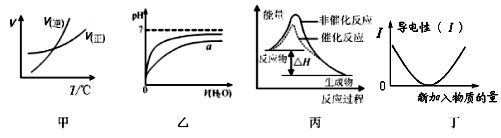
| A.由图甲表示的反应速率随温度变化的关系可知该反应的△H > 0 |
| B.若图乙表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
| D.图丁可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |