下列反应肯定不属于氧化还原反应的是
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
若以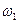 和
和 分别表示浓度为
分别表示浓度为 和
和 氨水的质量分数,且知2a=b,则下列推断正确的是(已知氨水的密度比纯水的小)( )
氨水的质量分数,且知2a=b,则下列推断正确的是(已知氨水的密度比纯水的小)( )
A. |
B.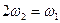 |
C. |
D.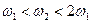 |
对于溶液中发生的离子反应,下列说法正确的是(  )
)
①不可能是氧化还原反应 ②只能是复分解反应 ③可能是置换反应 ④不能有分子参加
| A.①③ | B.③ | C.①② | D.③④ |
常温下,在溶液中可发生以下反应:① ===
=== ,
,
② ===
=== ,③
,③ ===
=== ,
,
由此判断下列说法错误的是()
A.还原性强弱顺序为: |
| B.Z元素在反应①中被氧化,在③中被还原 |
C.常温下可发生反应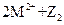 === ===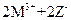 |
D.氧化性强弱顺序为: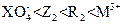 |
某溶液中含有Cl-、SO42-、Fe3+、K+、M,且离子物质的量之比为2∶3∶1∶3∶2,则微粒M可能为 ( )
| A.Na+ | B.Ag+ | C.Ba2+ | D.Mg2+ |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A.K+、MnO4-、Na+、Cl- | B.K+、Na+、NO3-、CO32- |
| C.Na+、H+、NO3-、SO42- | D.Fe3+、Na+、Cl-、SO42- |