I.下图是中学教材中铜与稀硝酸反应的实验装置,请就此回答下列问题:
(1)管A中发生反应的离子方程式是 。
⑵试管A中观察到的现象是 。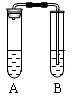
⑶试管B中盛装NaOH溶液的目的是 。
II.上述装置存在明显的不足,为克服上述缺点,某课外小组的学生设计了如图所示的装置。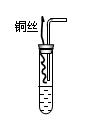
实验步骤如下:①检查装置的气密性;②向试管中加入一定量碳酸
钙固体;③向试管中加入过量稀硝酸,并迅速盖上带铜丝和导管的
橡皮塞;④待反应完全后,将导管插入试管内接近液面(如图);
⑤将铜丝插入到溶液中;⑥反应一段时间后,用注射器向试管内
推入氧气(或空气)。
请回答下列问题:
⑷实验中加入CaCO3的作用是 。
⑸实验④的实验目的是 。
⑹实验⑥中推入氧气或空气的目的是 。
下列实验能获得成功的是
| A.验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液 |
| B.除去苯中的少量苯酚:加入浓溴水振荡、静置后过滤,除去三溴苯酚沉淀 |
C.除去硝基苯中的硝酸:加入氢氧化钠溶液,振荡静置后 分液 分液 |
| D.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃与强碱醇溶液共热后,不发生消去反应,该醇可能是:
| A.1-戊醇 | B.3-戊醇 | C.2,2-二甲基-1-丙醇 | D.2-甲基-2-丁醇 |
某酯完全燃烧生成等物质的量的CO2和水,该酯水解可得羧酸B和醇C,把醇C氧化可得羧酸D,且B与D互为同分异构体。由此酯可能是:
| A.CH3CH2COOCH(CH3)2 | B.CH3CH2COOCH2CH=CH2 |
| C.(CH3)2CHCOOCH2CH(CH3)2 | D.CH3CH2CH2COOCH2CH(CH3)2 |
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。
有关该物质的说法中正确的是
| A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C.该分子中的所有碳原子不可能共平面 |
| D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol 和7mol |
下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是:
| A.C3H8、C4H6 | B.C3H6、C4H6O3 | C.C2H2、C6H6 | D.CH4O、C3H4O5 |