373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应: 其中物质PCl3的物质的量变化如右图所示。
其中物质PCl3的物质的量变化如右图所示。
(1 )前 20
)前 20 s内 PCl5(g)的平均反应速率为
s内 PCl5(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的 PCl5,与原平衡比较,新平衡时 PCl5的转化率 (填“增大”或“减小”,下同)。PCl5的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为 PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中 Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入 PCl3
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中的第_________周期,_________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________;
(4)Y的最高价氧化物的化学式为________________;
(5)W和Y形成的一种二元化合物具有色温效应,相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________。
卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质, E为相同物质的量的单质与H2反应过程中的能量变化(
E为相同物质的量的单质与H2反应过程中的能量变化( E越大,表明反应越容易发生)。
E越大,表明反应越容易发生)。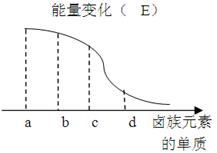
请回答下列问题:
d为_____(写化学式) ,红热的铜丝在b单质中燃烧的现象为.
b与H2反应的条件为______________ .
(2)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次.
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)下列元素的名称: A B C D
(2)写出AB2与足量氢氧化钠溶液反应的离子方程式。
(3)画出D的原子结构示意图, 用电子式表示化合物 C2D 的形成过程。
元素A的原子的L层比M层多6个电子,元素B的L层比K层多5个电子,则A的元素符号为,B的原子结构示意图是,A和B两元素形成的化合物的电子式是,它们形成的化合物中含有的化学键类型为___ ___(填“离子键”或“共价键”),该化合物属于________化合物(填“离子”或“共价”)。
(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为______热反应,该反应的能量转化是___________________________________。
(2)中和反应都是______热反应,其实质是_______________________________。