某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的 H2还原 CuO粉末来测定 Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲中发生反应的离子方程式
(2)为完成上述实验,正确的连接顺序为 A连; B连 (填写连接的字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为 。
(4)若检验氯气的氧化性,则乙装置的 a瓶中溶液可以是 ,对应的现象 为 。
(5)丙装置的 c瓶中盛放的试剂为 ,作用是 。
(6)测定 Cu的相对原子质量:精确测量硬质玻璃管的质量为Ag,放入CuO后,精确测量硬质玻璃管和 CuO的总质量为Bg,实验完毕后精确测量硬质玻璃管和 Cu粉的总质量为cg。Cu的相对原子质量表达式(用 a、b、c表示)为。(已知氧的相对原子质量为 16)
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上(填“有”或“没有”)气泡产生。
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。从上述现象中可以归纳出构成原电池的一些条件是,
有关的电极反应式:锌片;铜片。
图丙所示原电池中,电子流向为。
(3)图乙、图丙是一个将 能转化为 能的装置,人们把它叫做原电池。
下表是元素周期表的一部分,回答下列有关问题:(用元素符号或化学式填空)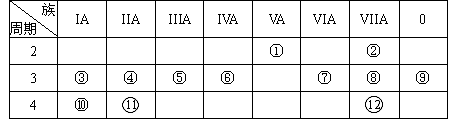
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明:答:________
在⑧与⑿中,化学性质较活泼的是________,怎样用化学实验证明?答:____________。(用化学反应方程式表示)
(每空1分,共12分)
(1)浓硫酸与木炭粉在加热条件下的化学方程式为____________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是_________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是__________,可验证的产物是__________。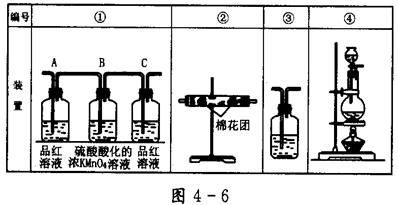
(每空1分,共9分)A、B、C、D四种元素的最高正价依次为1、4、5、7,其核电荷数按B、C、D、A的次序增大;已知B原子的次外层电子数为2,C、D、A原子的次外层电子数均为8;A原子核外电子总数不超过20。试回答:
(1)各元素符号为:A_____B_____C_____D_____
(2)写出B、D最高价氧化物对应水化物的分子式: ___、____,并比较其酸性强弱:_________
(3)写出分子BD4的电子式:
(4)用电子式表示AD的形成过程:
(每空1分,共6分)根据下列变化进行推断。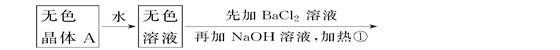 \x(气体B,遇HCl冒白烟白色沉淀C
\x(气体B,遇HCl冒白烟白色沉淀C
且已知强热A产生的气态物质的平均式量(平均相对分子质量)为26.3。
(1)推断A、B、C、D的化学式:A________,B________,C________,D________。
(2)写出①②变化的离子方程式:
①____________________________________________________;
②_____________________________________________________。