为了除去粗盐中Ca2+、Mg2+、SO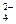 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ |
| C.②⑤④①③ | D.⑤②④①③ |
人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3—),它维持血液的pH稳定。已知在人体正常体温时,反应H2CO3 HCO3—+H+的平衡常数Ka=10—6.1,正常血液中[HCO3—]:[H2CO3]≈20:1,则关于血液缓冲体系的判断正确的是( )
HCO3—+H+的平衡常数Ka=10—6.1,正常血液中[HCO3—]:[H2CO3]≈20:1,则关于血液缓冲体系的判断正确的是( )
| A.正常人血液的pH约为7.4 |
| B.当过量的碱进入血液中时,发生的反应只有HCO3—+OH—→CO32—+H2O |
| C.血液中存在[HCO3—]+[OH—]+2[CO32—]=[H+]+[H2CO3] |
| D.正常人血液内不会存在以HCO3—/CO32—为主的缓冲体系 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE和CE含有相同类型的化学键
用下列装置进行的实验中,能达到其实验目的的是( )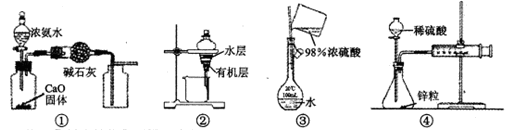
| A.用装置①制取并收集干燥纯净的NH3 |
| B.用装置②分离苯萃取碘水后已分层的有机层和水层 |
| C.用装置③配制一定的物质的量浓度的稀硫酸 |
| D.用装置④测定锌与稀硫酸反应的速率 |
以下对实验操作的说法正确的是( )
| A.配制FeCl3溶液时,应将FeCl3溶解在适量的盐酸中 |
| B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出 |
| D.酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测 |
常温下,下列离子浓度的关系正确的是( )
| A.pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
| D.相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O |