选择下列某种答案的序号, 填入下表的空格
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质 |
丁烷与 |
红磷 |
氯仿与 |
氕与 |
新戊烷与 |
| 名称 |
2--甲基丙烷 |
与白磷 |
三氯甲烷 |
氘、氚 |
2,2--二甲基丁烷 |
| 相互 |
|
|
|
|
|
| 关系 |
|
|
|
|
|
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为:;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为。
(4)E核外电子排布式是,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
(12分)某烃类化合物A的相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;
C的名称为;
E2的结构简式是;
④、⑥的反应类型依次是
 ;。
;。
某温度下,在2 L容器中3种物质间进行反应, X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,依图所示:
⑴①该反应的化学方程式是_____________________。
②在t1 min时,该反应达到了__________状态,下列可作为判断反应已达到该状态的是__________
| A.X、Y、Z的反应速率相等 |
| B.X、Y的反应速率比为2︰3 |
| C.生成3 mol Y的同时生成1 mol Z |
| D.生成1 mol Z的同时生成2 mol X |

 ⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。
⑵①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为:__________;在此t1 min时间内,用H2表示反应的平均速率v(H2)= __________。 ②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应, 乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们说法正确的是______同学。
(8分)(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为____ _ __;
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br] SO4和[Co (SO4) (NH3)5] Br,在第一种配合物的溶液中加BaCl2溶液时,现象是;如果在第二种配合物的溶液中加入BaCl2溶液时,现象是,若在第二种配合物的溶液加入 AgNO3溶液时,现象是。
下图中A~J均代表无机物或其水溶液,其中A是红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。已知B可以在高温下与金属活性不如其强的其他金属的氧化物发生置换反应。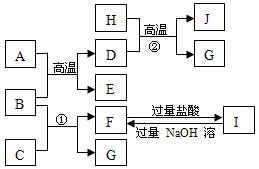
(1)写出下列物质的化学式:
AEI
(2)反应①的离子方程式是E是氧化物(填碱性或酸性或两性)
F与过量盐酸反应的离子方程式是
(3)J与盐酸反应的化学方程式是
反应后的溶液与氯气反应的离子方程式是