(14分)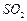 是一种大气污染物,某兴趣小组欲探究
是一种大气污染物,某兴趣小组欲探究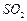 的性质及绿色实验的方法,设计如下方案。
的性质及绿色实验的方法,设计如下方案。
(1)装置A中发生反应的化学方程式为 ;
为了实现绿色实验的目标,甲同学重新设计了如下图A′制取装置:
与A装置相比,A′ 装置的优点是:
① ;
② ;
(2)换用A′ 装置后,继续进行下列实验。
 I.验证
I.验证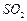 的氧化性:C装置中可选试剂 (填序号);
的氧化性:C装置中可选试剂 (填序号);
| A.Ba(HCO3)2溶液 | B.氢硫酸 | C.溴水 | D.品红溶液 |
II.验证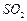 的还原性:C装置中可用试剂 (填名称);
的还原性:C装置中可用试剂 (填名称);
用该试剂的理由是① ;② ;
(3)D装置中导管下端倒置漏斗的作用是 ;
(4)工业生产硫酸有三个阶段,①其中用黄铁矿制备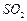 的化学反应方程式为:___________________________________________________,
的化学反应方程式为:___________________________________________________,
②尾气用氨吸收的目的是: 。w^w
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
A、乙醇 B、C、NaOH溶液。
(1)B中盛装的试剂(填化学式)
(2)A中加入乙醇的目的是。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是(用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:MnO4- + H2C2O4+ = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于(填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
| 实验组别 |
c(H2C2O4) /(mol/L) |
V(H2C2O4) /ml |
c(KMnO4) /(mol/L) |
V(KMnO4) /ml |
c(H2SO4) /(mol/L) |
褪色所需时间 |
实验 目的 |
| 1 |
0.2 |
2 |
0.0025 |
4 |
0.12 |
6'55'' |
(a) |
| 0.2 |
2 |
0.005 |
4 |
0.12 |
5'17'' |
||
| 0.2 |
2 |
0.01 |
4 |
0.12 |
3'20'' |
||
| 0.2 |
2 |
0.02 |
4 |
0.12 |
9'05'' |
||
| 0.2 |
2 |
0.03 |
4 |
0.12 |
11'33'' |
||
| 0.2 |
2 |
0.04 |
4 |
0.12 |
14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是。
实验室蒸馏工业酒精的正确操作顺序是:
| A.连结接收管 |
| B.装入素烧瓷片和工业酒精,塞上带温度计的塞子 |
| C.检查装置气密性 |
| D.连结冷凝管及进出水口 |
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶,塞上带温度计的塞子
G.加热
用18mol·L-1的浓H2SO4配制100mL浓度为1.8mol·L-1的H2SO4,其操作可分为以下各步:
a.用量筒量取10.0ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌
b.用约30mL蒸馏水,洗涤烧杯和玻璃棒三次,将每次洗涤液都倒入容量瓶里
c.将稀释后H2SO4冷却到室温后小心转移入容量瓶里
d.检查100mL容量瓶口部是否会发生滴漏
e.将蒸馏水直接加入容量瓶,至液面接近环形刻度线1-2cm处
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液
g.用向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
填写下列的空白
(1)步骤C中玻璃棒的作用是
(2)步骤g中空白处所用仪器名称为
(3)正确的操作顺序是(字母填写)
(4)该实验中应选择下列那种规格的容量瓶:
A.150mlB.100mlC.250ml
(5)误差分析,对所配溶液浓度的影响(填偏大,偏小或无影响)
①定容时,俯视刻度线:_____________________
②摇匀后液面低于刻度线后又加水 :_____________________
③配制前,容量瓶壁上有少量水:_______________________
④未洗涤烧杯和玻璃棒:______________________________。
某研究性学习小组对还原铁粉与水蒸气的反应的产物进行科学探究,已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃;根据下图所示实验装置,进行了还原铁粉与水蒸气反应的实验,实验中观察到肥皂液中产生大量气泡。
(1)实验中Ca(OH)2的作用是_____________,实验中的气体产物是
(2)为进一步探究还原铁粉与水蒸气反应产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体(纯净物)。针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:____________________________________________________
I、限选用下列试剂:盐酸、KSCN溶液、K3[Fe(CN)6]溶液、氯水证明假设一不成立。
其操作和现象为:
II、为了进一步确定产物的成分,用黑色固体进行了下列实验:
①加入足量氯水所发生反应的离子方程式是___________________________________________;
②灼烧时盛放固体的仪器是 _____________;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是_____________g。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2 2KMnO4+MnO2↓+2K2CO3
2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 |
K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
| 溶解度g/100g |
111 |
33.7 |
11.1 |
6.34 |
完成下列填空:
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和。(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
加酸时不宜用硫酸的原因是:;不宜用盐酸的原因是( )
(2)K2MnO4的转化2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
(3)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
已知 涉及到的反应:Na2C2O4+ H2SO4→H2C2O4(草酸)+Na2SO4
5H2C2O4+ 2MnO4—+6H+→2Mn2++10CO2↑+ 8H2O
Ⅰ 称取0.80 g的高锰酸钾产品,配成50 mL溶液。
Ⅱ 称取0.2014 gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为(保留3位小数)。达到滴定终点的标志是。
(4)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度。(填“偏高”、“偏低”或“无影响”)
(5)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,
其原因可能为。