下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。该组离子可能是 ( )
| A.Na+、Cu2+、NO3-、CO32- | B.Al 3+、K+、Cl-、HCO3- |
| C.Fe2+、 Na+、SO42-、NO3- | D.Mg2+、NH4+、SO42-、Cl- |
硼有两种天然同位素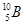 、
、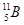 B,硼元素的近似相对原子质量为10.80,则对硼元素中
B,硼元素的近似相对原子质量为10.80,则对硼元素中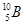 的质量分数判断正确的是( )
的质量分数判断正确的是( )
| A.20% | B.略大于20% | C.略小于20% | D.80% |
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是( )
| A.16O2与18O2互为同分异构体 |
| B.16O与18O核外电子排布方式不同 |
| C.通过化学变化可以实现18O与16O间的相互转化 |
| D.标准状况下,1.12 L16O2和1.12 L18O2均含0.1NA个氧原子 |
下列化学用语正确的是( )
| A.Na2O2中氧元素的化合价是-2 | B.乙醇的分子式:CH3CH2OH |
C.16S的结构示意图: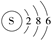 |
D.甲烷的结构式为: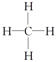 |
下列各组离子,能在指定溶液中大量共存的是()
①无色溶液中:K+ ,
, Br-,Na+,HCO3-
Br-,Na+,HCO3-
②使pH试纸变深蓝的溶液中:K+,CO32-,Na+,AlO2-
③水电离产生的C(H+)=10-12mol·L-1的溶液中:ClO-,CO32-,NO3-,NH4+,SO32-
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl-,Na+,SO42-
⑤使甲基橙变红的溶液中:MnO4-,NO3-,Na+,SO42-,Fe3+
⑥PH=0溶液中:Fe2+,Al3+,NO3-,Cl-
| A.①③⑥ | B.①②④⑤ | C.①④⑤ | D.③⑥ |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离)其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气、的物质的量与溶液中剩余的Fe2+的物质的量之比为()
| A.7:1 | B.7:2 | C.7:3 | D.7:4 |