在一密闭的容器中,反应aA(g) 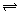
 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数增加了 | D.a > b |
在Na2O2与H2O的反应中,氧化剂和还原剂的质量比是
| A.1:1 | B.1:2 | C.2:1 | D.8:53 |
除去MgO中的Al2O3可选用的试剂是
| A.NaOH溶液 | B.硝酸 | C.浓硫酸 | D.稀盐酸 |
实验室中少量金属钠常常保存在
| A.水中 | B.煤油中 | C.密封容器中 | D.棕色瓶内 |
0.12mol/L的NaCl、MgCl2、AlCl3三种溶液各500mL中Cl-的物质的量浓度
| A.相同 |
| B.无法比较 |
| C.依次为0.12mol/L、0.24mol/L、0.36mol/L |
| D.依次为0.06mol/L、0.12mol/L、0.18mol/L |
在标准状况下,下列物质占体积最大的是
A.98g H2SO4B.6.02×1023个氮分子
B.44.8L HCl D.6g氢气