下列叙述正确的是
| A.含金属元素的离子不一定是阳离子 |
| B.一种元素可形成多种离子,但只能是带同种电荷的离子 |
| C.由同种元素组成的物质肯定属于纯净物 |
| D.具有相同质子数的粒子都属于同种元素 |
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是()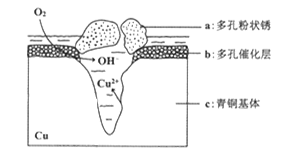
| A.腐蚀过程中,负极是a |
| B.正极反应是 O2 + 4e-+2H2O = 4OH- |
| C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况) |
| D.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ |
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是()
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是()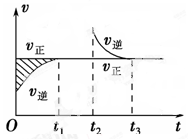
| A.Z和W在该条件下均为非气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的 平均摩尔质量不可能相等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2 (g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是()
A、容器①中达到平衡时,Y2的转化率为50%
B、Q="27.78" kJ
C、相同温度下;起始时向容器中充入1.0 X2 mol 、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆)
D、容器①、②中反应的平衡常数相等,K=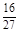
某研究性学习小组将下列装置如图连接,D、F、X、Y 都是铂电极、C、E是铁电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。下列说法不正确的是()
A、电源B 极的名称是负极
B、甲装置中电解反应的总化学方程式是: CuSO4+Fe Cu+ FeSO4
Cu+ FeSO4
C、设电解质溶液过量,则同一时内C、D电极上参加反应的单质或生成的单质的物质的量之比是1:1
D、设甲池中溶液的体积在电解前后都是500ml,当乙池所产生气体的体积为4.48L(标准状况)时,甲池中所生成物质的物质的量浓度为0.2mol/L
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g) 2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
2AB3(g)ΔH<0,相关数据如下表所示:ΔH<0,相关数据如下表所示:
| 容器 |
甲 |
乙 |
丙 |
| 相关条件 |
恒温恒容 |
绝热恒容 |
恒温恒压 |
| 反应物投料 |
1mol A2、3mol B2 |
2mol AB3 |
2mol AB3 |
| 平衡时容器体积 |
V甲 |
V乙 |
V丙 |
| 反应的平衡常数K= |
K甲 |
K乙 |
K丙 |
| 平衡时AB3的浓度/mol·L-1 |
c甲 |
c乙 |
c丙 |
| 平衡时AB3的反应速率/mol·L-1·min-1 |
v甲 |
v乙 |
v丙 |
下列说法正确的是()
A、v甲=v丙 B、c乙>c甲C、V甲>V丙D、K乙<K丙