常温常压下,甲、乙两容器带有相同质量的活塞且容积相等,
甲容器中盛有二氧化氮气体,乙容器中盛有空气,现分别进
行下列两实验:(已知:N2O4(g) 2NO2(g) △H> 0)
2NO2(g) △H> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加1 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| Ks或Ka |
Ksp=1.8×10-10 |
Ksp=2.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
C.碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 + Cl2+H2O =HCO-3+Cl-+HClO
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO2-4先形成沉淀
电化学降解NO3-的原理如图所示。下列说法中正确的是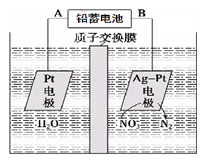
| A.铅蓄电池的A极为负极,电极材料为Pb |
| B.铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 |
| C.该电解池的阴极反应为2NO3- + 12H++ 10e- = N2↑ + 6H2O |
| D.若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(Δm左—Δm右)为14.4g |
有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。下列推断正确的是
| A.肯定有Al3+、Mg2+、Cl-,可能有NH4+ |
| B.肯定有Al3+、Mg2+、HCO3-,肯定没有MnO4- |
| C.肯定有K+、Al3+、MnO4-,可能有HCO3- |
| D.肯定有Al3+、Mg2+、Cl-,可能有K+ |
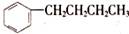 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
| A.7种 | B.6种 | C.5种 | D.4种 |
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是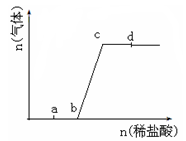
| A.a点对应的溶液中:Na+、OH-、SO42-、NO3-- |
| B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |