有下列四种溶液①0.01mol/L的H2S溶液;②0.01mol/L的NaHS溶液;③0.02mol/L的HCl与0.04mol/L的NaHS溶液等体积混合液;④0.02mol/L的NaOH与0.02mol/L的NaHS溶液等体积混合液;下列有关微粒浓度大小比较错误的是
| A.c(H+)由大到小的顺序是:①>③>②>④ |
| B.c(H2S)由大到小的顺序是:③>①>②>④ |
| C.c (S2-)由大到小的顺序是:④>②>③>① |
| D.c(HS-)由大到小的顺序是:③>④>②>① |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |
已知反应:mX(g)+nY(g)  qZ(g) ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法中正确的是
qZ(g) ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法中正确的是
| A.通入稀有气体使压强增大,平衡将向正反应方向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量,Y的转化率降低 |
在101 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+ O2(g)===H2O(g)ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g)ΔH1=-241.8 kJ·mol-1
H2(g)+ O2(g)===H2O(l)ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH2=-285.8 kJ·mol-1
下列说法错误的是
| A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 |
B.O2前面的 表示参加反应的O2的分子数目 表示参加反应的O2的分子数目 |
| C.燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ·mol-1 |
D.1 molH2和 molO2所具有的总能量大于1mol H2O(g)所具有的总能量 molO2所具有的总能量大于1mol H2O(g)所具有的总能量 |
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+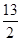 O2(g)===4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
②C4H10(g)+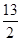 O2(g)===4CO2(g)+5H2O(g)ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g)ΔH=-2 658 kJ·mol-1
③C4H10(g)+ O2(g)===4CO(g)+5H2O(l)ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l)ΔH=-1 746 kJ·mol-1
④C4H10(g)+ O2(g)===4CO(g)+5H2O(g)ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g)ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是
| A.ΔH=-2 878 kJ·mol-1 | B.ΔH=-2 658 kJ·mol-1 |
| C.ΔH=-1 746 kJ·mol-1 | D.ΔH=-1 526 kJ·mol-1 |
80℃时,2L密闭容器中充入0.40molN2O4,发生反应N2O4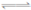 2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
2NO2 △H=+QkJ·mol-1(Q>0) ,获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是
A.升高温度该反应的平衡常数K减小
B.20~40s内,v(N2O4)=0.004mol/(L·s)
C.反应达平衡时,吸收的热量为0.30QkJ
D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大