用如下装置可以完成一系列实验(图中夹持装置已略去)。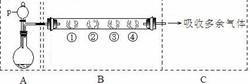
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
④ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
| 现象 |
|
|
褪色 |
浅黄色 |
| 体现SO2的性质 |
|
|
|
|
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式: 。
A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期且相邻,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是________________,乙物质的电子式是____________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________(用元素符号填写)。
(3)E的单质遇到A的最高价氧化物对应的水化物的浓溶液会发生____________现象;但加入到C的最高价氧化物对应的水化物的溶液中能反应,反应的离子方程式是:_______。
(4)丙与水反应生成两种碱性物质,试写出该反应的化学方程式____________。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为。
(3)根据上述反应可推知。
| A.氧化性:KBrO3>H3AsO4 | B.氧化性:H3AsO4 > KBrO3 |
| C.还原性:AsH3>X | D.还原性:X > AsH3 |
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥标出电子转移的方 向和数目:
向和数目: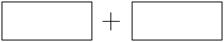
下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。
试回答下列问题: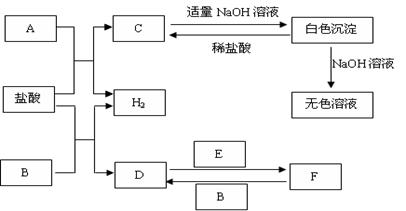
(1)A在周期表中的位置是;
(2)检验F中金属阳离子的常用方法是。
(3)白色沉淀与NaOH溶液反应的离子方程式是。
(4)反应F→D的化学方程式是。
(1)材料是人类赖以生存和发展的重要物质基础。
①生产水泥的主要原料是黏土和(填名称)。
②橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施可增大强度和弹性,硫化后的橡胶是结构。(选填“线型”或“体型”)。
(2)人体健康与食品关系密切。
①有些学生从小偏食,不爱吃水果、蔬菜,结果营养缺乏、发育不良,这主要是由于摄取(选填“脂肪”、“维生素”或“蛋白质”)不足引起的。
②生活中应合理地摄取人体必需的元素,体内元素含量过低,会引起甲状腺疾病。
③糖类、油脂、蛋白质都是人体必需的营养物质。其中蛋白质被摄入人体后,在酶的作用下水解为(写名称)。
(3)人体健康与药物等关系密切:
人的纯净胃液是一种无色液体,呈酸性,PH在0.9~1.5之间,其中H+的浓度比血液中高几万倍,回答下列问题:
①液有帮助人体消化食物等多种功能,胃酸的主要成份是
②若胃酸酸度增大就会患胃酸过多症,下列物质不宜用做治疗胃酸过多的药物是
| A.小苏打 | B.氢氧化铝 | C.氢氧化钠 | D.碳酸镁 |
③胃舒平的主要成份是氢氧化铝,不溶于水且作用持久,写出该药物中和胃酸的离子方程式。
④可以帮助流感病人解热镇痛的药物是(选填“青霉素”或“阿司匹林”)。
(4)洁净安全的生存环境更是健康的保障。
①某农村地区洪涝灾害后为获得饮用水,在将地表水取回家后,先加明矾,再过滤,去除悬浮在水中的较大颗粒;过滤后常使用漂白粉进行杀菌消毒,
其原理可用化学方程式表示为。
②氯气与氢氧化钙溶液反应能制得漂白粉。试写出工业制漂白粉反应的化学方程式:。
③通道口设有专门垃圾箱,箱体上标有下图所示,下图图标表示 。
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答: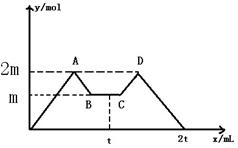
(1)AB段所表示的反应的离子方程式是;
CD段所表示的反应的离子方程式是。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是。
(3)a是______________,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)= _____________________
_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
试通过计算确定400℃剩余固体成分的化学式。(写出计算过程)