下列反应中,氧化剂与还原剂的物质的量之比为1∶2的是( )
①O3+2KI+H2O===2KOH+I2+O2 ②SiO2+2CSi+2CO↑
③SiO2+3CSiC+2CO↑ ④4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
| A.仅有② | B.仅有②④ | C.①②③④ | D.仅有②③④ |
现有三组溶液:①煤油和氯化钾溶液 ②35%的乙醇溶液 ③碘单质和氯化钠固体,分离以上各混合体系最合适的方法依次是()
| A.分液、蒸馏、萃取 | B.萃取、蒸馏、升华 |
| C.分液、蒸馏、升华 | D.蒸馏、分液、萃取 |
下列物项属于非电解质的是()
| A.SO3 | B.BaSO4 | C.Cl2 | D.CH3COOH |
下列各组表述中,两个粒子一定不属于同种元素原子的是
| A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 |
| B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 |
| C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子 |
| D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子 |
下列说法不正确的是
| A |
B |
C |
D |
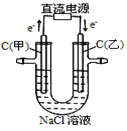
| 通电一段时间后, 搅拌均匀,溶液的 pH增大 |
甲电极上的电极反应为: 2Cl--2e-= Cl2↑ |
Pt电极上的电极反应为: O2+2H2O+4e-==4OH- |
总反应的离子方程式 为:2Fe3++Cu=Cu2++ 2Fe2+ |
 |
 |
 |
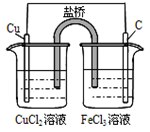 |
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-  Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,石墨电极附近溶液变红 |
| C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e-=2Cl- |
| D.断开K1,闭合K2时,石墨电极作正极 |