用20 mL 0.1mol/L的含氧酸HxRO4溶液与15 mL 0.2mol/L的某碱M(OH)a溶液恰好完全反应,全部生成正盐,则R元素的化合价是( )
A.+(8-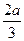 ) ) |
B.+(8-2a) | C.+(8-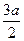 ) ) |
D.+(8-3a) |
某主族元素的离子X2+外围电子层排布为6S2,当把X的最高价氧化物溶于浓盐酸时,有黄绿色气体产生,则下列说法不正确的是()
| A.X2+具有还原性 | B.X的最高价氧化物具有强氧化性 |
| C.该元素是第ⅥA族元素 | D.X的+2价化合物比+4价化合物稳定 |
下列分子中的中心原子杂化轨道的类型相同的是( )
| A.BeCl2与BF3 | B.CO2与SO2 | C.CH4与H2O | D.C2H2与C2H4 |
下列对价电子构型为2s22p5的元素描述正确的是()
| A.原子半径最小 | B.非金属性最强 |
| C.第一电离能最大 | D.电负性最大 |
下列对化学平衡移动的分析中,不正确的是 ( )
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动;②已达到平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动;②已达到平衡的反应N2(g)+3H2(g)  2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高;③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动;④有气体参加的反应达到平衡后,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高;③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动;④有气体参加的反应达到平衡后,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①②③④ |
在密闭容器中,反应X2(g)+Y2(g)≒2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是.( )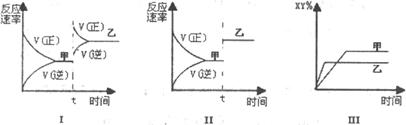
| A.图I是加入适当催化剂的变化情况 | B.图II是扩大容器体积的变化情况 |
| C.图III是增大压强的变化情况 | D.图III是升高温度的变化情况 |