在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下:

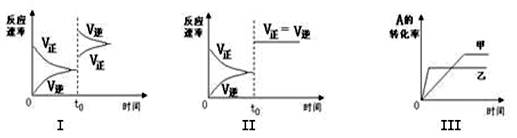
下列分析中不正确的是
| A.图I可体现t0时升高温度对反应速率的影响 |
| B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图III可体现温度对化学平衡的影响,且乙的温度较高 |
已知1 g CH4完全燃烧生成CO2和液态水时放出55.6 kJ的热量,则下列甲烷燃烧的热化学方程式正确的是
| A.CH4+CO2==CO2+2H2O ΔH =-889.6 kJ·mol-1 |
| B.CH4(g)+2O2(g)==CO2(g)+2H2O(g)ΔH =-889.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH =+889.6 kJ·mol-1 |
| D.CH4(g)+2O2(g)==CO2(g)+2H2O(l)ΔH =-889.6 kJ·mol-1 |
草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是
A.(K+)+c(H+)=c(HC2O )+c(OH-)+c(C2O )+c(OH-)+c(C2O ) ) |
B.c(HC2O )+c(C2O )+c(C2O )=0.1mol·L-1 )=0.1mol·L-1 |
C.c(C2O )<c(H2C2O4) )<c(H2C2O4) |
D.c(K+)=c(H2C2O4)+c(HC2O )+c(C2O )+c(C2O ) ) |
下列有关反应限度的叙述正确的是
| A.大多数化学反应在一定条件下都有一定的限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度 |
| D.FeCl3与KSCN反应达到平衡时,向其中滴加KCl溶液,则溶液颜色变深 |
对于达到平衡状态的可逆反应:N2+3H2 2NH3 (正反应为放热反应)下列叙述中正确的是
2NH3 (正反应为放热反应)下列叙述中正确的是
| A.反应物和生成物的浓度相等 |
| B.反应物和生成物的浓度不再发生变化 |
| C.降低温度,平衡混合物里氨气的浓度减小 |
| D.增大压强,不利于氨的合成 |
增大压强,对以达到平衡的下列反应产生的影响是3P(g)+Q(g) 2R(g)+2S(s)
2R(g)+2S(s)
| A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正、逆反应速率都增大, 平衡向正反应方向移动 |
| D.正、逆反应速率都没有变化, 平衡不移动 |