如图所示,两个与水平倾角同为θ的滑杆上分别套有质量同为m的A、B两个圆环,两个圆环上分别用细线悬吊着两个质量同为M的物体C、D,当它们沿滑杆向下滑动时,A的悬线与杆垂直,B的悬线竖直向下,则C环运动的加速度为___________;B环受到的摩擦力为___________。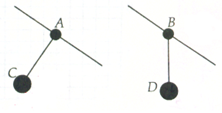
两个力合力最大值15N,最小值3N,且F1>F2,则两个已知力F1=_____N,F2=______N。
某物体以30 m/s的初速度竖直上抛,不计空气阻力,(g取10 m/s2)物体上升的最大高度为m,物体在抛出5s内位移大小为m,5s时物体速度大小为m/s.
有一个电流表G,内阻Rg=30 ,满偏电流Ig=1mA。若要把它改装为量程0—3V的电压表,需要给它联一个阻值为
,满偏电流Ig=1mA。若要把它改装为量程0—3V的电压表,需要给它联一个阻值为 的电阻,改装后电压表的内阻为
的电阻,改装后电压表的内阻为 。
。
已知电流表的内阻Rg=120 Ω,满偏电流Ig=3 mA,要把它改装成量程是6 V的电压表,应串联______Ω电阻?要把它改装成量程是3 A的电流表,应并联______Ω电阻.
两长度和横截面积均相同的电阻丝的伏安特性曲线如图所示,求两电阻丝的电阻值之比为________,电阻率之比为________.