(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
(8分) 有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦)
如图所示,通电5 min后,电极5的质量增加了2.16 g,回答: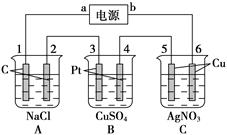
(1)电源:a是________极,C池是________池。
A池阳极电极反应式为__________________,阴极电极反应式为__________________。
C池阳极电极反应式__________________,阴极电极反应式为_____________________。
(2)如果B槽中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______________________。
(3)如果A池溶液也是200 mL(电解过程中溶液体积不变),则通电后,溶液的pH为[________。
(10分)在一个固定体积为2升的密闭容器中,充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)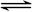 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1) 写出该反应平衡常数的表达式_____________________,2分钟内B 的平均反应速度为_____________________;
(2) 若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为______(填“吸热”或“放热”)反应;
(3) 若将容器体积缩小至1升,反应达到平衡时C的浓度为___________mol/L,平衡常数___________ (填“增大”、“减小”或“不变”)。
(10分)下图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t表示时间。试回答: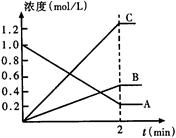
(1)该反应的反应物是。
(2)该反应的化学方程式为。
(3)达到平衡状态的所需时间是2min,A物质的平均反应速率为
(4)其他条件不变,压缩容器容积,平衡______________(填向正或逆方向或不)移动;若正方向吸热,则升高温度,平衡平衡___________(填向正或逆方向或不)移动。
(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种铵盐;E与A同主族;元素D的2价阴离子的核外电子排布与氖原子相同;A和E都能与D形成X2Y、X2Y2型化合物。
(1) 写元素符号是: B_____ ; E_______ 。
(2) C的氢化物的电子式_______,其水溶液具有_____性(酸/中/碱)
(3) B的最高价氧化物与E2D2反应的化学方程式为 ____。