25℃时,向体积为10mL 0.1mol/L NaOH溶液中逐滴加入0.1mol/L的CH3COOH溶液,曲线如右图所示,有关离子浓度关系的比较中,错误的是 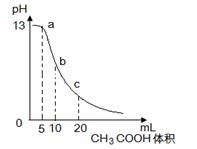
| A.a点处: c(Na+)> c(CH3COO—)> c(OH—)>c(H+) |
| B.b点处:c(CH3COOH)+c(H+)=c(OH—) |
| C.c点处: c(CH3COOH)+ c(CH3COO—)="2" c(Na+) |
| D.NaOH溶液和CH3COOH溶液任意比混合时: |
c(Na+)+c(H+)=c(OH—)+ c(CH3COO—)
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是
2AlN + 3CO下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2molAlN,N失去6mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝是氧化产物 |
下列反应中属于氧化还原反应,且水作为氧化剂的是
| A.Cl2+H2O=HCl+HClO | B.2Na+2H2O=2NaOH+H2↑ |
| C.2F2+2H2O=4HF+O2 | D.2Na2O2+2H2O=4NaOH+O2↑ |
下列离子方程式正确的是
| A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O |
| B.少量金属钠放入冷水中:Na + 2H2O = Na+ + 2OH- + H2↑ |
| C.氧化铜溶于硫酸:O2―+2H+=H2O |
| D.碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
若A+酸==盐+水,则A不可能属于
| A.氧化物 | B.单质 | C.碱 | D.电解质 |
在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
| A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在 |
| C.氯水滴在PH试纸上,一段时间后将观察到试纸变红,说明H+存在 |
| D.加入NaOH溶液,氯水浅黄绿色消失,说明有HClO分子存在 |