如图是红磷P(s)和Cl2(g)发生反应生成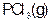 和
和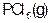 的反应过程和能量关系图。其中
的反应过程和能量关系图。其中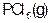 分
分 解成
解成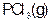 和
和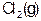 的反应是一个可逆反应,温度t℃时,在密闭容器中加入0.6
的反应是一个可逆反应,温度t℃时,在密闭容器中加入0.6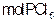 ,达平衡时
,达平衡时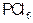 还剩0.45mol,其分解率为
还剩0.45mol,其分解率为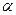 ,则下列推断不正确的是
,则下列推断不正确的是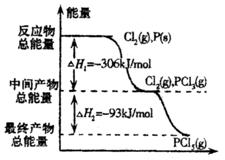
A.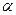 等于25% 等于25% |
B.若升高温度,平衡时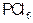 的分解率大于 的分解率大于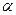 |
C.若超始时加入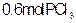 和0. 和0.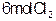 ,以相同条件进行反应,则平衡时 ,以相同条件进行反应,则平衡时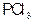 转化率为3 转化率为3 |
D.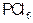 分解的热化学方程式为 分解的热化学方程式为 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是:
| A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
下列说法中,正确的是:
| A.0.1 mol·L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.室温下,某溶液中由水电离的出H+浓度为10-amol/L,a<7时,溶液的pH为a或14 -a |
与纯水的电离相似,液氨中也存在着微弱的电离: 2NH3 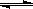 NH4++NH2-,据此判断以下叙述中错误的是:
NH4++NH2-,据此判断以下叙述中错误的是:
| A.液氨中含有NH3、NH4+、NH2-等微粒 |
| B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数 |
| C.液氨的电离到达平衡时C(NH3)=C(NH4+)=C(NH2-) |
| D.只要不加入其他物质,液氨中C(NH4+)=C(NH2-) |
如右下图,电解用粗盐(含 、
、 、
、 等杂质)配制的食盐水,以下说法正确的是:
等杂质)配制的食盐水,以下说法正确的是:
| A.a是电解池的正极 | B.a电极上发生还原反应 |
| C.b电极附近有白色沉淀出现 | D.b电极上有黄绿色气体产生 |
已知:H2(g)+F2(g)=2HF(g);△H=-270kJ/mol,下列说法正确的是:
| A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 |
| B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ |
| C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量 |