“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为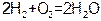 ,负极反应为
,负极反应为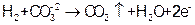 ,则下列推断中,正确的是
,则下列推断中,正确的是
| A.通氧气的电极为阳极,发生氧化反应 |
| B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极 |
C.正极的电极反应为: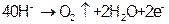 |
D.电池工作时,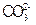 向负极 向负极 移动 移动 |
卤素单质的性质,与F2>Cl2>Br2>I2的变化规律不相符的是()
| A.与氢气反应的剧烈程度 | B.气态氢化物的稳定性 |
| C.单质还原性的强弱 | D.与水反应的程度 |
欲将氯化钠、沙子(主要成分为SiO2)、碘三种物质组成的固体混合物分离,最科学的操作顺序是()
| A.溶解、过滤、加热(升华)、蒸发(结晶) |
| B.加热(升华)、溶解、过滤、蒸发(结晶) |
| C.升华、溶解、蒸馏、结晶 |
| D.溶解、结晶、过滤、升华 |
下列液体分别与溴水混合,振荡静置后上层液体呈橙色,下层液体呈无色的是()
| A.四氯化碳 | B.苯 | C.氯水 | D.溴化钾溶液 |
下列反应在通常情况下可以发生:①2FeCl3+Cu====2FeCl2+CuCl2
②Fe+CuSO4====FeSO4+Cu③2FeCl3+2KI====2FeCl2+2KCl+I2
④6FeCl2+3Br2====4FeCl3+2FeBr3,则下列氧化性强弱顺序正确的是( )
| A.Br2>Fe3+>I2 | B.Fe3+>Br2>I2 | C.Br2>I2>Fe3+ | D.Fe2+>Cu2+>Fe3+ |
正好能还原1 mol H+的是( )
| A.17 g OH- | B.23 g Na | C.71 g Cl2 | D.9 g Al |