将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。下列叙述不正确的是
| A.消耗铝的质量相等 |
| B.NaOH溶液和盐酸的体积相等 |
| C.两反应中转移的电子数相等 |
| D.反应中生成的NaAlO2和AlCl3物质的量相等 |
在一个体积不变的密闭容器中发生可逆反应:A2(g)+B2(g) 2AB(g),达到平衡的标志是
2AB(g),达到平衡的标志是
A.容器的总压强不随时间而变化
B.容器内气体的密度不再改变
C.单位时间内有nmolA2生成的同时有nmolB2消耗
D. v正(A2)= 2v逆(AB)
反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s) B.v(A)= 0.030mol/(L ·s)
C.v(C)=0.040mol/(L· s) D.v(D)=0.060mol/(L· s)
下列说法正确的是
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
| A.①③⑥ | B.②④⑥ | C.②③④ | D.①③⑤ |
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是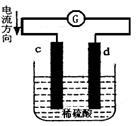
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
一种氢氧燃料电池用30%KOH溶液为电解质溶液,有关这种电池的说法中错误的是
| A.H2在负极发生氧化反应 |
| B.供电时的总反应为:2H2 + O2 = 2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.负极反应为:H2 - 2e- = 2H+ |