将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100 mL物质的量浓度为2.2 mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28 g。过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL)。向滤液中加入2 mol/L NaOH溶液至40mL时开始出现沉淀。则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为
| A.1.8 mol/L | B.2 mol/L | C.2.2 mol/L | D.无法计算 |
下列说法正确的是( )
| A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 |
| B.煤的干馏是物理变化,煤的气化和液化是化学变化 |
| C.纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |
D.聚碳酸酯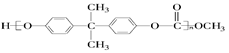 中含有 中含有 结构 结构 |
结构如图的某有机物在一定条件下可以用于合成植物的生长素。下列关于该有机物的说法错误的是()
| A.该有机物的化学式为C11H12N2O2 |
| B.该有机物能够与强碱反应 |
| C.一定条件下既可发生加成和酯化反应 |
| D.一定条件下会发生加聚反应生成蛋白质 |
使蛋白质从水溶液中析出而又不变质的方法是
| A.过滤 | B.加入硫酸铵溶液 |
| C.加入硫酸铜溶液 | D.分液 |
下列关于糖类、油脂和蛋白质的说法中,正确的是()
A.它们的组成中都有C、H、O、N等元素
B.在一定条件下,它们都能发生水解反应
C.人体需要的二十多种氨基酸都可以通过人体自身合成
D.油脂是热值最高的营养物质,也是一种重要的工业原料
两名日本科学家与一名美国科学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质,而获得2010年的诺贝尔化学奖。下列说法正确的是()
| A.有机物中一定含有碳和氢两种元素 |
| B.一定条件下,使用催化剂能提高反应的平衡转化率 |
| C.将有机物进行“缝合”可以不遵循质量守恒定律 |
| D.将有机物进行“裁剪”需要破坏旧的化学键 |