设NA为阿伏加德罗常数,下列说法中正确的是
| A.1mol Na2O2中所含阴离子数为2NA |
| B.0.5 molH2O含有的原子数目为1.5NA |
| C.标准状况下,22.4LH2O含有氢原子个数为2NA |
| D.11.2L氢气一定含有NA个氢原子 |
离子检验的常用方法有三种:
| 检验方法 |
沉淀法 |
显色法 |
气体法 |
| 含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法不合理的是()
A.Ba2+------------气体法 B.Cl—-----------沉淀法
C.Fe3+-----------显色法 D.NH4+-----------气体法
在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断不正确的是( )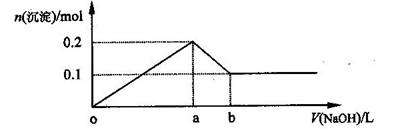
| A.NaOH的浓度为0.6 mol/L | B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 | D.图中线段oa : ab=5 : 1 |
从下列事实所得出的结论或给出的解释正确的是()
| 实验事实 |
结论或解释 |
|
| ① |
将40 g NaOH溶于1 L蒸馏水中 |
该溶液中溶质的质量分数为3.84%,其物质的量浓度为1 mol·L-1 |
| ② |
向盛有1mL 0.1mol·L-1 AgNO3溶液的试管中滴加0.1mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加 0.1mol·L-1 KI溶液,白色沉淀转化为黄色沉淀。 |
常温下,S(AgCl) < S(AgI) |
| ③ |
Mg(OH)2难溶于水但可溶于NH4Cl溶液 |
NH4Cl水解显酸性,Mg(OH)2与H+发生反应 |
| ④ |
某盐NaX溶液pH > 7 |
酸HX为弱酸 |
| ⑤ |
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 |
说明溶液中一定含有Fe2+ |
| ⑥ |
向盛有浓硝酸的试管中分别加入Al片和Cu片,前者没有明显现象,后者反应剧烈,产生大量红棕色气体 |
还原性Al < Cu |
| ⑦ |
BaSO4的水溶液导电性很差 |
BaSO4是弱电解质 |
A.①⑤⑥ B.④⑤ C.③④⑥⑦ D.③④⑤⑦
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与醋酸反应 |
CO32—+2CH3COOH=" " CO2↑+ H2O+2CH3COO— |
错误,碳酸钙是 弱电解质,不应 写成离子形式 |
| B |
向AlCl3溶液中加入过量的氨水 |
Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+ |
错误,碱过量, 应生成AlO2— |
| C |
NaHCO3的水解 |
HCO3—+H2O CO32—+H3O+ CO32—+H3O+ |
正确 |
| D |
等物质的量的 FeBr2和Cl2反应 |
2Fe2+ + 2Br—+ 2Cl2 = 2Fe3+ + Br2 + 4Cl— |
正确 |
下列指定溶液中,各组离子可能大量共存的是()
| A.pH=1的溶液中:K+、Fe2+、C1—、NO3— |
| B.加入Al能放出H2的溶液中:NH4+、SO42—、C1—、HCO3— |
| C.在含有大量Fe3+的溶液中:NH4+、C1—、Na+、SCN— |
| D.由水电离的c(OH—)=10—13mol·L—1的溶液中:Ba2+、Na+、C1—、Br— |