下列表达式中能精确计算任意浓度[c(NaOH)]的NaOH溶液中氢氧根离子的浓度[c(OH-)]的是(Kw表示水的离子积)( )
| A.c(OH-)=c(NaOH) | B.c(OH-)=c(NaOH)+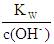 |
| C.c(OH-)=c(NaOH)+KW | D.c(OH-)=c(NaOH)-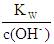 |
【2015重庆理综化学】下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 |
| C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
【2015浙江理综化学】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ) |
C.随着CO2的通入, 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
【2015新课标Ⅰ卷理综化学】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随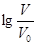 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当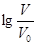 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则 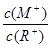 增大 增大 |
【2015安徽理综化学】汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
A.温度T下,该反应的平衡常数K= |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
【2015上海化学】对于合成氨反应,达到平衡后,以下分析正确的是
| A.升高温度,对正反应的反应速率影响更大 |
| B.增大压强,对正反应的反应速率影响更大 |
| C.减小反应物浓度,对逆反应的反应速率影响更大 |
| D.加入催化剂,对逆反应的反应速率影响更大 |