设NA表示阿伏加德罗常数的值,下列说法正确的是  ( )
( )
| A.2.4g镁在二氧化碳中燃烧所转移的电子总数为0.2NA |
| B.7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2 NA |
| C.1 L1 mol/L的Na2CO3(aq)中CO32-与HCO3-的离子数之和为NA |
| D.1 mol NaHSO4晶体中离子总数为3NA |
在一定固定的密闭容器中,放入3mol X(g)和2mol Y(g),在一定条件下发生反应: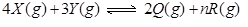 ,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是()
,达平衡后,容器内温度不变,平衡后压强比原来增加5%,X的浓度减小,则该反应方程式中的n值是()
| A.3 | B.4 | C.5 | D.6 |
在一密闭容器中进行下列反应: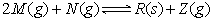 。在反应达到平衡后保持温度不变,若缩小容器的体积,则混合气体的平均相对分子质量()
。在反应达到平衡后保持温度不变,若缩小容器的体积,则混合气体的平均相对分子质量()
| A.一定增大 | B.一定减小 | C.一定不变 | D.不能确定 |
反应PCl5(g)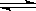 PCl 3(g)+Cl2(g)①
PCl 3(g)+Cl2(g)①
2HI(g)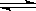 H2(g)+I2(g)②
H2(g)+I2(g)②
2NO2(g)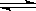 N2O4(g)③
N2O4(g)③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 |
| C.①增大,②不变,③减少 | D.①减少,②不变,③增大 |
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
| A.Z为0.3mol/L | B.Y2为0.4mol/L |
| C.X2为0.2mol/L | D.Z为0.4mol/L |
下列能用勒沙特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往使用过量的空气 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |