下列溶液中各微粒的浓度关系正确的是
| A.等pH值的氨水、KOH溶液、Ba(OH)2溶液中: c(NH4+)=c(K+)=2c(Ba2+) |
| B.0.1 mol/L 的CH3COONa溶液中:c(CH3COO-) > c(Na+) >c(OH-) >c(H+) |
| C.常温时向NH4HSO4溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(SO42-) |
| D.将10 mL 0.1 mol/L Na2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中: |
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
下列反应的离子方程式正确的是
A.苯酚钠溶液中通入少量二氧化碳: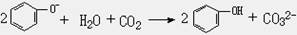 |
| B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++ 2HCO3- + 2OH- = CaCO3↓+ CO32- + 2H2O |
| C.碳酸钙溶于稀硝酸中:CO32-+ 2H+= H2O + CO2↑ |
| D.少量Cl2通入KI溶液中:Cl2+ 2I- = 2C1-+ I2 |
下列说法全不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
| A.①② ⑥ | B.②③④ | C.②③⑥ | D.③⑤⑥ |
下列有机物的命名正确的是
A.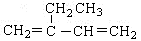 : 2—乙基—1,3—丁二烯 : 2—乙基—1,3—丁二烯 |
| B.CH3CH2CH2CH2OH:丁醇 |
C.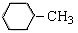 :甲苯 :甲苯 |
| D.HOCH2CH2CH2OH: 1,3-二丙醇 |
下列各组中的反应,属于同一反应类型的是

| A.乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
| C.甲苯硝化制TNT;乙烯氧化制乙醛 |
D.  乙醇脱水制乙烯;溴乙烷消去制乙烯 乙醇脱水制乙烯;溴乙烷消去制乙烯 |
某烃的化学式为C4Hm,下列关于C4Hm的说法中正确的是
| A.当m=8时,该烃与乙烯一定互为同系物 |
| B.当m=4时,该烃一定含有碳碳双键 |
| C.该烃不可能同时含有碳碳双键和碳碳三键 |
| D.当m=10时,该烃分子中共价健数目最多 |