赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿和辉铜矿混合加热发生下列反应: 2 Cu2O + Cu2S =" 6" Cu + SO2
| A.该反应的氧化剂只有Cu2O | B.Cu2S在反应中既有氧化剂又有还原剂 |
| C.Cu 既是氧化产物又有还原产物 | D.每生成192 克铜,反应中转移6 mol电子 |
关于下列各实验装置图的叙述中,错误的是 

| A.①可用于分离苯和溴苯的混合物 | B.①可用于分离乙酸和乙醇的混合物 |
| C.②可用于分解NH4Cl制备NH3 | D.②可用于Ca(OH)2与NH4Cl共热制备NH3 |
实验装置如图所示。下列说法正确的是
| A.该装置不能发生原电池反应 |
| B.活性炭是阴极 |
| C.总反应为:4Al+3O2 +6H2O → 4Al(OH)3 |
| D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
从碘的四氯化碳溶液中除去碘以回收四氯化碳,下列操作最简便的是
| A.向其中放入过量镁条,反应完毕后取出 |
| B.蒸馏 |
| C.加入能氧化I2的KMnO4,再分液 |
| D.通入氯气 |
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是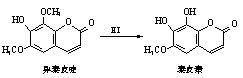
| A.异秦皮啶与秦皮素互为同系物 |
| B.异秦皮啶分子式为C11H12O5 |
| C.秦皮素一定条件下能发生加成反应、消除反应和取代反应 |
| D.1mol秦皮素最多可与2molBr2、4molNaOH反应 |
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是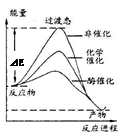
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |